Establecimientos
Establecimiento dedicado a la fabricación, control de calidad, reacondicionamiento, comercialización, importación, exportación, almacenamiento, distribución, atención farmacéutica, preparados farmacéuticos, expendio de productos farmacéuticos, dispositivos médicos o productos sanitarios entre otras actividades según su Clasificación y que debe contar con autorización sanitaria de funcionamiento. Fuente: Reglamento de Establecimientos Farmacéuticos DS N° 014-2011-SA.
- Trámites, formatos e instructivos para obtener autorización
- Trámites, formatos e instructivos para obtener certificación
- Guía para generar el Expediente Maestro de Sitio (Sie Master File)
- Consultas
- Almacenes Especializados, Droguerías y Laboratorios autorizados
- Resoluciones Directorales de Autorización Sanitaria de Funcionamiento
- Almacenes Especializados y Droguerías certificadas
- Laboratorios certificados
- Listado de laboratorios nacionales autorizados y certificados
- Lista de laboratorios extranjeros certificados
- Listado de Laboratorios Fabricantes Extranjeros de Productos Farmacéuticos que se encuentran pendientes de Certificación en Buenas Prácticas de Manufactura
- Supervisión y Monitoreo
- Teleconferencia
- Base de Datos de Actividades de Pesquisa de Productos Farmacéuticos y Publicidad Descentralizadas
- Base de Datos de Actividades de Comercio Ilegal, Control y Vigilancia Sanitaria Descentralizadas
Control y Vigilancia de Establecimientos
Las inspecciones inopinadas a los laboratorios del territorio nacional realizadas por la DIGEMID, siguen una frecuencia en base a criterios de riesgo, entre estos criterios se tienen en cuenta las características de los procesos de manufactura de la empresa, los resultados del control de calidad de los productos pesquisados y la cantidad y tipo de observaciones de la última inspección realizada, entre otros aspectos.
La Unidad Funcional de Laboratorios (UFLAB) de la DIGEMID ha procedimentado la forma de analizar los aspectos de riesgo más importantes, así como la frecuencia que corresponde a cada uno de los niveles de riesgo posibles para los laboratorios del territorio nacional. Asimismo se han procedimentado los aspectos correspondientes al desarrollo de los distintos tipos de inspecciones a laboratorios.
El Área de Inspección y Certificación de Laboratorios (AICLAB) de la DIGEMID ha implementado herramientas informáticas, mediante las cuales todas las características de riesgo de los laboratorios del territorio nacional se ponderan a fin de determinar con exactitud el nivel de riesgo para cada uno de ellos. El nivel de riesgo obtenido asociado a las características particulares de cada laboratorio son las entradas del sistema para determinar las prioridades del Plan de Inspecciones. De esta forma, las inspecciones a laboratorios se planifican oportunamente para asegurar que los productos farmacéuticos, dispositivos médicos y productos sanitarios fabricados por la industria nacional cumplan con la calidad, seguridad y eficacia requeridas.
Las inspecciones a laboratorios se ajustan a lo siguiente:
- Los inspectores realizan inspecciones durante las horas de funcionamiento, sin necesidad de previa notificación, en cualquier establecimiento farmacéutico o comercial. Para la realización de las inspecciones se requiere de dos (02) inspectores como mínimo;
- Para ingresar al establecimiento farmacéutico o no farmacéutico, el o los inspectores deben estar identificados y acreditados.
- Los inspectores realizan la inspección con la presencia del representante legal del establecimiento, el Director Técnico o, en todo caso, con la persona que se encuentra en el establecimiento al momento de la inspección;
- Una vez concluida la inspección, el inspector levantará un acta, en el que se refleje el resultado obtenido. El acta se suscribirá por duplicado, con indicación del lugar, fecha y hora de la inspección, el detalle de las deficiencias encontradas y las recomendaciones formuladas, así como los plazos para subsanarlas, de ser el caso. En el acta debe constar, si los hubiere, los descargos del administrado.
- El acta será firmada por los inspectores y la persona con la que se llevó a cabo la inspección. En caso que éste se negara a firmar, en el acta se deja constancia del hecho, sin que ello afecte su validez;
- Cuando en el acto de la inspección se disponga la aplicación de una medida de seguridad sanitaria de cierre temporal se debe indicar el motivo de cierre y elevar el acta correspondiente, en un plazo no mayor de cinco (05) días de realizada la inspección, al titular del órgano encargado del control y vigilancia sanitaria, a fin que éste, mediante Resolución Directoral, ratifique, modifique o suspenda la medida adoptada, sin perjuicio de su aplicación inmediata y sin perjuicio de las sanciones que corresponda.
Los inspectores están facultados a:
- Verificar las instalaciones y equipos del establecimiento;
- Solicitar la exhibición de los libros de recetas, libro de control de estupefacientes, psicotrópicos y precursores cuando corresponda, libro de ocurrencias, recetas retenidas, las facturas y boletas de adquisición y venta, inventarios, contratos de fabricación o de control de calidad por encargo, la documentación relativa a la fórmula maestra, especificaciones y procedimientos para la fabricación, procedimiento para las diferentes operaciones que involucran el almacenamiento, distribución y transporte, los protocolos y certificados de análisis, entre otros documentos, según corresponda;
- Solicitar, cuando se requiera, la documentación relacionada al producto o dispositivo, insumo, materiales, equipo o maquinaria para la verificación o solicitar copia de la misma;
- Realizar todo tipo de controles, pesquisas, verificaciones, inspecciones, operativos (propios o conjuntos), pudiendo contar con participación de otras entidades;
- Realizar la verificación documentaria y control de los productos o dispositivos que son autorizados excepcionalmente de acuerdo al Reglamento correspondiente;
- Inmovilizar o incautar productos farmacéuticos, dispositivos médicos y/o productos sanitarios que cuenten con alguna observación sanitaria o a efectos de verificación, así como insumos, materiales, equipos o maquinarias, en cualquier lugar donde se encuentren;
- Portar equipos de comunicación audiovisuales e informáticos, para evidenciar o documentar los hallazgos detectados al momento de la inspección. Este hecho debe ser comunicado al inicio de la inspección;
- Cerrar temporalmente todo o parte del establecimiento, según corresponda;
- Tomar muestras de los productos o dispositivos para su análisis en cualquiera de las etapas de los procesos de fabricación, almacenamiento, distribución, comercialización, así como de los insumos, materias primas y materiales de envase y empaque, solo en caso de riesgo sanitario. EL fabricante, importador, distribuidor o comercializador está obligado, cuando se le requiera, a entregar las muestras correspondientes;
- Aislar productos o dispositivos, insumos, materiales, equipos o maquinarias;
- Suspender el proceso de fabricación en cualquiera de sus etapas, solo en caso de riesgo sanitario;
- Suspender el acto inspectivo por razones debidamente justificadas;
- Demás facultades conferidas en los Reglamentos y normas sanitarias correspondientes.
Facilidades para la inspección:
- El propietario, representante legal, administrador, el Director Técnico, encargado o quien se encuentra presente en el establecimiento farmacéutico y no farmacéutico en el momento de la inspección, está obligado a prestar a los inspectores todas las facilidades para el desarrollo de la inspección.
Texto basado en los arts 135°, 136° y 137° del Reglamento de Establecimientos Farmaceuticos, consulte el documento completo del Reglamento y la Ley N° 29459
Control y Vigilancia de Productos
Contra el Comercio Ilegal
El uso de medicamentos falsificados constituye un riesgo grave para la salud de la población, ya que puede tratarse de medicamentos:
- Con los ingredientes incorrectos, por lo tanto podría contener otras sustancias activas que pueden afectar adversamente la salud de las personas.
- Sin principios activos, es decir, no habrá efecto terapéutico.
- Con principios activos insuficientes, es decir, no habrá efecto terapéutico o bien no será el apropiado.
- Con envasado incorrecto, es decir, cuyo envase declare o informe otro producto.
- Que se desconoce la calidad de los ingredientes y del producto mismo, pudiendo contener productos de degradación o impurezas o contaminantes nocivos para la salud.
- Que se desconocen las condiciones de fabricación, y por lo tanto, se desconocen las condiciones sanitarias a las que estuvo expuesto el producto.
- Cuya estabilidad es desconocida, por lo tanto, puede que esté degradado o no apto para el consumo.
- No ha sido demostrada la calidad, seguridad y eficacia para su uso en pacientes humanos.
- Se desconocen las condiciones de almacenamiento a las que ha estado sometido el producto.
Registro sanitario:
Instrumento legal otorgado por la Autoridad Nacional de Productos Farmacéuticos, Dispositivos médicos y productos sanitarios que autoriza la fabricación, importación y comercialización de los productos farmacéuticos y dispositivos médicos previa evaluación en base a criterios de eficacia, seguridad, calidad y funcionabilidad, según corresponda.
Producto falsificado:
Producto farmacéutico, dispositivo médico o producto sanitario manufacturado indebidamente de manera deliberada y fraudulenta en lo que respecta a su identidad o su origen. Puede incluir productos con los ingredientes correctos o con los ingredientes incorrectos, sin ingredientes farmacéuticos activos (IFAs), con ingredientes farmacéuticos activos (IFAs) insuficientes o incorrectos o con envase o inserto falsificado.
Producto o dispositivo contaminado:
Es aquel que contiene microorganismos, parásitos, materiales extraños, substancias u otros ajenos a sus elementos autorizados en el registro sanitario, potencialmente dañinos para la salud.
Producto o dispositivo adulterado:
Es aquel cuya composición, especificaciones, características u otras contempladas en el respectivo registro sanitario o notificación sanitaria obligatoria han sido modificadas con el propósito de ocultar una alteración, o de extraer o agregar total o parcialmente algunos de los ingredientes o componentes.
Mal estado de Conservación:
Productos o dispositivos cuyos envases inmediato o mediato se encuentran deteriorados, maltratados, rotos o en condiciones inadecuadas de conservación.
Fecha de expiración o vencimiento:
Es el dato señalado en el rotulado de los envases mediato e inmediato del producto o dispositivo que indica el mes y el año calendario más allá del cual no se garantiza que el producto o dispositivo conserve su estabilidad y eficacia
Procedencia desconocida:
Producto farmacéutico, dispositivo médico o producto sanitario adquirido de proveedores clandestinos o informales, por lo que, no se puede sustentar su procedencia legal.
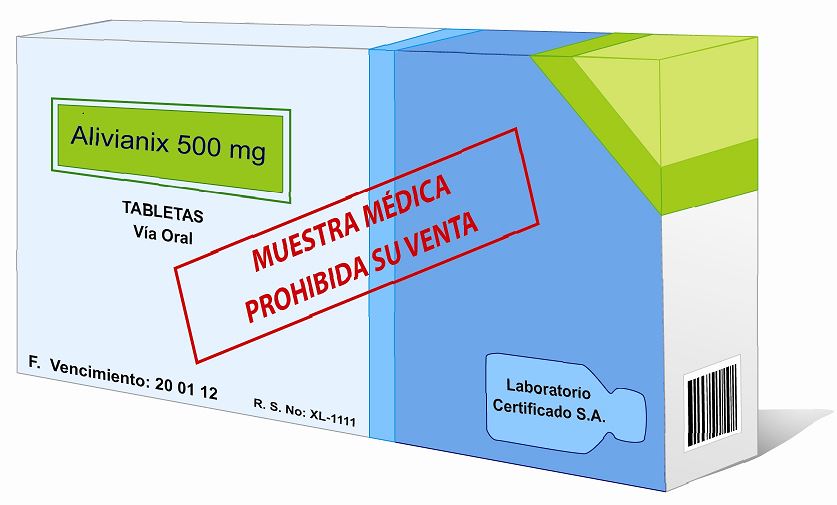
Muestra médica:
Es la presentación reducida en cantidad, de un producto farmacéutico sujeto a publicidad y promoción, la cual el visitador médico entrega sin costo a los profesionales facultados para prescribir, con la finalidad de fomentar la prescripción y/o para recordarles la existencia de una marca comercial. Debe indicar en su rotulado “Muestra Médica Prohibida Su Venta”.
Observaciones Sanitarias:
Es la detección de un hecho irregular previa percepción, análisis e identificación, que se realiza durante el proceso de evaluación y es respaldado mediante la evidencia objetiva del hallazgo.
Autorización Sanitaria:
Los establecimientos dedicados a la fabricación, importación, exportación, almacenamiento, distribución, comercialización, dispensación, y expendio de productos farmacéuticos, dispositivos médicos o productos sanitarios, requieren de autorización sanitaria previa a su funcionamiento.
La Ley N° 29459 “Ley de los Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios”, prohíbe las siguientes actividades:
- Venta ambulatoria de productos farmacéuticos, así como los dispositivos médicos y productos sanitarios que sean estériles o asépticos y en lugares no autorizados por las autoridades de productos farmacéuticos, dispositivos médicos y productos sanitarios a nivel nacional.
- La fabricación, importación, almacenamiento, distribución, comercialización, publicidad, dispensación, tenencia y la transferencia de cualquier tipo de productos farmacéuticos, dispositivos médicos o productos sanitarios sin registro sanitario, falsificados, contaminados, en mal estado de conservación o envases adulterados, con fecha de expiración vencida, de procedencia desconocida, sustraído u otra forma con fines ilícitos..
- La venta de medicamentos, otros productos farmacéuticos, dispositivos médicos y productos sanitarios procedentes de instituciones públicas en establecimientos privados.
- La venta de muestras médicas en establecimientos públicos y privados
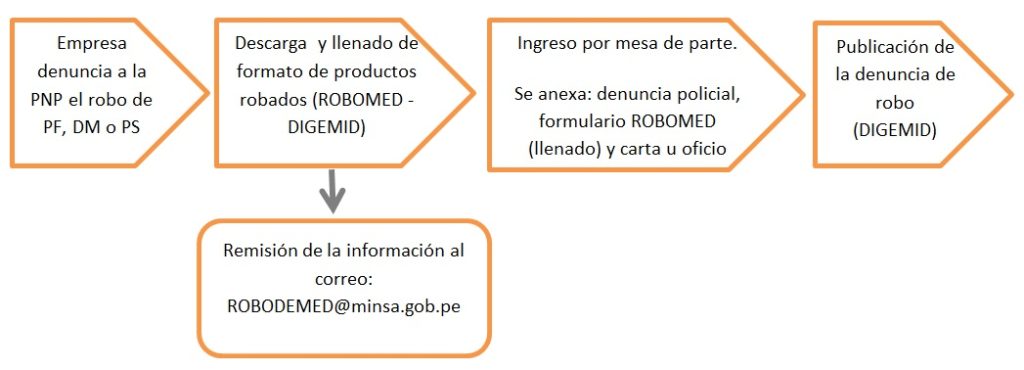
Leyenda:
-
- PNP: Policía Nacional del Perú
- PF: Producto farmacéutico
- DM: Dispositivo médico
- PS: Producto sanitario
Si después de leer esta información tienes indicio de algún hecho de comercio ilegal de productos farmacéuticos, dispositivos médicos o productos sanitarios, realiza tu denuncia con el siguiente enlace:
Control de la Promoción y Publicidad
El Control de la Promoción y Publicidad Farmacéutica en nuestro país es posterior y está a cargo del Área de Control Publicitario, unidad orgánica de la Dirección de Inspección y Certificación de la DIGEMID. Ello, se sustenta en la Ley de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios N° 29459 y en el D.S. N° 016-2011-SA, y su modificatoria D.S. Nº 001-2012-SA y en el D.S. N°014-2011. Asimismo, este Control se basan en los Criterios Éticos para la Promoción de Medicamentos de la Organización Mundial de la Salud y se ejecuta en cumplimiento del D.S. Nº 008-2017, Artículo 89° incisos b), n), p), q), r) y s), que sustentan nuestras obligaciones funcionales como Autoridad Nacional del Medicamento (ANM).
Vigilar, monitorear y evaluar el cumplimiento del Control Publicitario a nivel nacional, cautelando el cumplimiento de los Dispositivos Legales vigentes, para evitar la automedicación irracional por los consumidores, influenciados por la Promoción y Publicidad Farmacéutica.
Esta función que ya está descentralizada, y lo viene ejecutando las Direcciones Regionales de Salud-DIRESA, Gerencias Regionales de Salud-GERESAS, y las Direcciones de Salud-DISA, en todas las regiones del país.
Velar y Controlar que se brinde a los profesionales de la salud y a la población, información de calidad, objetiva y veraz, en las publicidades de los productos farmacéuticos, dispositivos médicos y productos sanitarios, difundidos a través de los diferentes medios de comunicación social o estrategias específicas a nivel nacional.
- Contrarrestar la influencia de la publicidad ejerciendo el Control posterior de las publicidades captadas y pesquisadas, promoviendo el cumplimiento de las Normas Publicitarias.
- Optimizar la Normatividad que cautela la publicidad, para que las empresas ejerzan un marketing ético a favor de la población.
- Monitorear y asistir a las DISAs, DIRESAs y GERESAs, para una mejor efectivización del control publicitario farmacéutico a nivel nacional.
- Establecer alianzas estratégicas con las asociaciones de consumidores u otras instituciones, para fortalecer las acciones de control y vigilancia sanitaria de la promoción y/o publicidad de productos farmacéuticos, dispositivos médicos y productos sanitarios.
- Promover la mejora continua en la aplicación del Proceso de Control Publicitario Farmacéutico, en aplicación de un sistema de Gestión de la Calidad ISO 9001:2015.
CALIDAD ISO 9001-2015
Nuestro Equipo logró en marzo del 2018 la certificación de la versión 2015 en el Sistema de Gestión de la Calidad ISO 9001. Ello evidencia nuestra vocación de servicio hacia la población y sustenta el deseo de frenar el impacto que tienen las publicidades engañosas o promociones irregulares, las cuales ponen en riesgo la salud de los consumidores por la Automedicación no informada. A la fecha se viene propulsando el proceso de Descentralización en todo el país en relación al rubro publicitario, realizando Asistencias Técnicas y Monitoreando las diferentes DIRESAs, GERESAs y DISAs de nuestro país, con resultados bastante positivos.
FINALIDAD
Salvaguardar y proteger la Salud de la población, frenando el impacto que ejerce la Promoción y la Publicidad de productos farmacéuticos, dispositivos médicos, productos sanitarios, cautelando que los consumidores obtengan información objetiva, veraz y actualizada que limite la automedicación un tanto irracional.
El post control abarca a todos los anuncios publicitarios de productos farmacéuticos, dispositivos médicos y productos sanitarios que se difunden a nivel local, regional y nacional, a través de los diferentes medios de comunicación social, y de las actividades dirigidas a los profesionales Prescriptores y Dispensadores.
La información publicitaria con fines de promoción y publicidad de productos farmacéuticos, dispositivos médicos y productos sanitarios debe ser concordante con lo autorizado en el registro sanitario y sujetarse a lo que establece la Ley N° 29459 – Nov. 2009 y su Reglamento DS N° 016-2011-SA, modificado por el DS. N° 001-2012-SA.
Asimismo, esta información debe ajustarse a los “CRITERIOS ETICOS PARA LA PROMOCIÓN DE MEDICAMENTOS DE LA ORGANIZACIÓN MUNDIAL DE LA SALUD (OMS), cuyo objetivo es apoyar y fomentar el mejoramiento de la atención sanitaria mediante el uso racional y adecuado de los mismos. Estos criterios complementan y fortalecen la regulación sobre promoción y publicidad, cubriendo ciertos vacíos existentes en la normatividad actual, y se afianzan y especifican más en los Criterios Éticos de la Comunidad Andina (Diciembre 2 011), que han sido trabajados y aprobados en consenso con los países miembros.
Los anunciantes, dentro de los cuales se pueden encontrar los Titulares de los Registros Sanitarios y los Titulares de los Certificados de los Registros Sanitarios de los Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios, son responsables de la información que se brinda en los anuncios que publicitan por los diferentes medios, en los cuales debe estar implícito la ética publicitaria.
Estos anuncios se deben ser dirigir exclusivamente a los profesionales que prescriben o dispensan, y no al público en general. La información contenida debe darse de manera veraz, exacta, visible, legible, completa y actualizada, si se difunde información científica, clínica o farmacológica debe de estar sustentada y actualizada en su registro sanitario.
Por excepción, los anuncios de introducción se dirigen a estos profesionales, en medios de comunicación masiva escrita, bajo las siguientes especificaciones, que se encuentran dispuestas en el reglamento (D.S N° 016-2011-SA):
- Nombre del producto farmacéutico o dispositivo médico;
- Denominación Común Internacional del Ingrediente Farmacéutico Activo-IFA, aun si esta contiene hasta 3 Ingrediente(s) Farmacéutico(s) Activo(s) – IFA(s), debajo del nombre de manera clara y legible;
- Cuando se trate de un producto homeopático, se debe consignar la frase “Producto Homeopático”, seguida del nombre científico del recurso natural usado en su fórmula;
- Forma farmacéutica;
- La cantidad de Ingrediente Farmacéutico Activo-IFA (expresado en unidad de dosis o concentración) de cada uno. En caso que se trate de un producto medicinal homeopático, se deberá consignar el grado de dilución;
- Forma de presentación;
- Número de registro sanitario;
- Nombre, dirección y/o teléfono del titular del registro sanitario, indicando específicamente que existe más información disponible sobre el producto. Si el producto es importado, lleva además el nombre, dirección y/o teléfono del importador
La publicidad de este tipo de productos, debe incluir la información técnica científica aprobada a manera de inserto o ficha técnica específica
La publicidad de estos productos debe realizarse en aplicación de la normativa vigente, con los siguientes criterios:
Siempre que aluda a las indicaciones terapéuticas o acción farmacológica del producto debe necesariamente consignar o referirse a las principales advertencias y precauciones que deben observarse para su uso; con un tamaño de letra Arial de ocho (08) puntos y en forma proporcional con el resto del anuncio, promoviendo así su lectura y comprensión por parte del público consumidor. (Art. 41º de la Ley Nº 29459 y D.S 016-2011-SA).
En el caso de productos farmacéuticos y dispositivos médicos, los anuncios televisivos deben consignar las principales precauciones y advertencias en forma clara, legible y con un tamaño de letra que sea perceptible (adecuado) por el consumidor, las leyendas escritas deben tener una duración proporcional al tiempo que dure el spot. En el caso de anuncios radiales la información debe ser difundida y pronunciada en el mismo ritmo y volumen que el anuncio, en términos claros y comprensibles. (Artículo 194° del DS N° 016-2011-SA, modificado por el DS. N° 001-2012-SA.)
La publicidad debe ser concordante con lo autorizado en su registro sanitario, incluyendo información relevante a los consumidores que le permitan hacer un uso correcto del dispositivo (principales advertencias y precauciones).
La muestra médica es la presentación reducida en cantidad de un producto farmacéutico sujeto a publicidad y promoción, la cual el visitador médico entrega sin costo a los profesionales facultados para prescribir, con la finalidad de fomentar la prescripción y/o para recordarles la existencia de una marca comercial. Debe indicar en su rotulado (caja y/o etiqueta) “Muestra médica Prohibida su Venta”
Según nuestra legislación vigente, no está justificada ni permitida la entrega de muestras médicas o muestras gratuitas, de productos farmacéuticos autorizados para venta con receta médica, directamente a los pacientes o público en general. La entrega de muestras gratuitas a la población no tiene justificación médico- sanitaria. (Art. Nº 197, 202 D.S. Nº 016-2011-SA y el D.S. Nº 014-2011-SA).