Sistema Peruano de Farmacovigilancia y Tecnovigilancia
La DIGEMID, en el año 1999, con RD N°354-99-DG-DIGEMID crea el Sistema Peruano de Farmacovigilancia, con la finalidad de identificar, evaluar y prevenir los riesgos asociados al consumo de los medicamentos. En febrero del año 2002, Perú se constituye en el país número 67 en formar parte del Programa Internacional de Farmacovigilancia de la OMS. En el año 2009, la Ley N° 29459, Ley de los productos farmacéuticos, dispositivos médicos y productos sanitarios, artículo 35° señala que la DIGEMID conduce el Sistema Peruano de Farmacovigilancia y Tecnovigilancia. En este marco en julio del 2014, se publica el Decreto Supremo N° 13-2014 SA, que dictan Disposiciones referidas al Sistema Peruano de Farmacovigilancia y Tecnovigilancia, en el que se menciona los integrantes y objetivos del Sistema Peruano de Farmacovigilancia y Tecnovigilancia
Para cualquier consulta adicional, hacerlo llegar vía correo eléctronico :
[email protected]
Son objetivos del Sistema Peruano de Farmacovigilancia y Tecnovigilancia de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios:
- Contribuir al cuidado y seguridad de los pacientes en relación al uso de productos farmacéuticos, dispositivos médicos y productos sanitarios.
- Contribuir a la salud pública en relación al uso de productos farmacéuticos, dispositivos médicos y productos sanitarios.
- Promover los estándares respecto a la seguridad de los productos farmacéuticos, dispositivos médicos y productos sanitarios.
- Contribuir al uso seguro y racional de los productos farmacéuticos, dispositivos médicos y productos sanitarios, analizando la relación beneficio riesgo.
- Minimizar el riesgo asociado al uso de productos farmacéuticos, dispositivos médicos y productos sanitarios, mediante la recolección, evaluación y difusión de la información sobre reacciones adversas e incidentes adversos.
- Contribuir en la evaluación del beneficio y riesgo de los productos farmacéuticos, dispositivos médicos y productos sanitarios, con la realización de estudios epidemiológicos.
Fuente: Decreto Supremo N° 13-2014 SA, que dictan Disposiciones referidas al Sistema Peruano de Farmacovigilancia y Tecnovigilancia
El Decreto Supremo N° 13-2014 SA, que dictan Disposiciones referidas al Sistema Peruano de Farmacovigilancia y Tecnovigilancia, menciona los integrantes del Sistema Peruano de Farmacovigilancia y Tecnovigilancia:
- La autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM).
- Los órganos desconcentrados de la Autoridad Nacional de Salud (OD)
- Las autoridades regionales de salud, a través de las autoridades de productos farmacéuticos
- Centro Nacional de Farmacovigilancia y Tecnovigilancia (CENAFyT)
- Los Centros de Referencia Regional de Farmacovigilancia (CRR)
- Los Centros de Referencia Institucional de Farmacovigilancia (CRI)
- Los Titulares de Registro Sanitario y del certificado de registro sanitario.
- La sanidad de las Fuerzas Armadas y de la policía nacional del Perú
- El seguro social de salud (Es Salud)
- Los establecimientos de salud públicos y privados
- Los establecimientos Farmacéuticos
- Los profesionales de salud
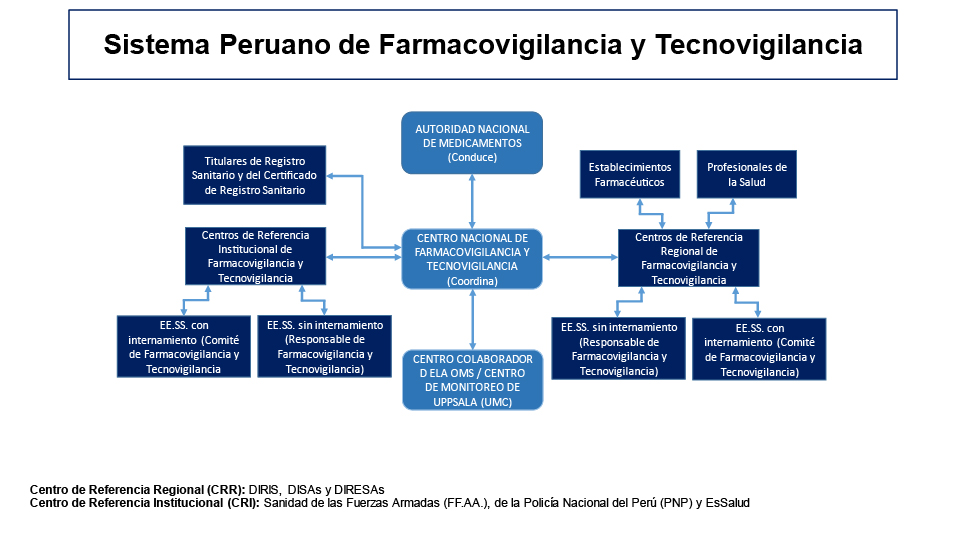
El Centro Nacional de Farmacovigilancia y Tecnovigilancia (CENAFyT), se encuentra a cargo de la Dirección de Farmacovigilancia, Acceso y Uso (DFAU) de la DIGEMID y tiene como funciones:
- Formular e implementar lineamientos, normas, planes, estrategias, programas y proyectos, así como conducir, vigilar, monitorear y evaluar el Sistema Peruano de Farmacovigilancia y Tecnovigilancia.
- Evaluar la Información sobre la seguridad de los productos farmacéuticos, dispositivos médicos y productos sanitarios, generada en el marco del Sistema Peruano de Farmacovigilancia y Tecnovigilancia, y adoptar medidas con enfoque de riesgo, así como promover su implementación en coordinación con los diferentes niveles de gobierno según corresponda.
Indicadores del 2025:
Indicadores del 2024:
- Indicadores 2024
- Resultados de la evaluación de desempeño en tecnovigilancia 2024
- Resultados de la evaluación de indicadores de FV y TV 2024
Indicadores del 2023:
- Resultados de los Indicadores de Actividades de Farmacovigilancia y Tecnovigilancia 2023 – I
- Resultados de la evaluación de indicadores de FV y TV 2023
Indicadores del 2022:
Indicadores del 2021:
- Indicadores de Gestión en Farmacovigilancia y Tecnovigilancia Semestre I-2021
- Resultados de la evaluación de indicadores de FV y TV 2021
Indicadores del 2020:
Indicadores del 2019
Indicadores del 2018
Indicadores del 2017
Indicadores del 2016
Indicadores del 2015
Indicadores del 2014
Indicadores del 2013
Indicadores del 2012
Indicadores del 2011
Indicadores del 2010
Evaluación Comparativa Cumplimiento de los Indicadores Farmacovigilancia
Indicadores del 2009
Indicadores del 2008
Resultados del 2007
Farmacovigilancia
La Farmacovigilancia es una actividad de salud pública, se define como la ciencia y las actividades relacionadas con la detección, evaluación, compresión y prevención de los efectos adversos de los medicamentos o cualquier otro problema relacionado con ellos. Se ocupa de los efectos indeseados o reacciones adversas medicamentosas (RAM) producidos pos los medicamentos principalmente, aunque no exclusivamente, ya que se ha extendido a hierbas, medicamentos complementarios, productos hemoderivados y biológicos, vacunas y dispositivos médicos, errores de medicación, falta de eficacia y otros. La Farmacovigilancia se ocupa de la detección, evaluación y la prevención de los riesgos asociados a los medicamentos una vez comercializados (OMS2001).
- Documento de orientación para la identificación y notificación de sospechas de reacciones adversas a medicamentos u otros productos farmacéuticos
- Formatos de Notificación de sospechas de Reacciones Adversas
- Evaluación de la Causalidad de las sospechas de RAMs
- Pacientes / Usuarios
- Profesionales de la salud
- Titulares de registro sanitario y titulares del certificado de registro sanitario
- Establecimientos de salud y centros de referencia regional e institucional
- VIGIFLOW: Notificación electrónica de sospechas de reacciones adversas a medicamentos u otros productos farmacéuticos eventos supuestamente atribuidos a la vacunación e inmunización (ESAVI) para establecimientos de salud centros de referencia regional e institucional
Documento que describe el conjunto de actividades de farmacovigilancia e intervenciones destinadas a identificar, caracterizar, prevenir o minimizar los riesgos de los medicamentos incluida la evaluación de su eficacia, e incorpora un programa específico de prevención o minimización de riesgos, incluyendo las actividades de formación e información a profesionales y usuarios. Los planes de gestión de riesgo involucran la descripción de las especificaciones de seguridad de un producto farmacéutico, su plan de farmacovigilancia, la evaluación de la necesidad de las actividades de minimización del riesgo y el plan de minimización de riesgos. Para su elaboración se toma en cuenta lo estipulado en las guía emitidas por la Conferencia Internacional de Armonización(ICH) y la Agencia Europea de Medicamentos(EMA).
El Plan de Gestión de Riesgo se debe presentar:
- Junto con la solicitud de autorización para:
-
- IFA nuevo (inscripción)
- Producto biológico o biosimilar (inscripción y reinscripción)
- A requerimiento de la autoridad reguladora: Asimismo, cuando exista un cambio significativo en la relación beneficio riesgo de uno o mas IFAs por nueva indicación, nueva forma farmacéutica, nueva vía de administración, un nuevo excipiente o un nuevo proceso de fabricación de producto biológico, o si considera que la evidencia disponible justifica la modificación de un problema de seguridad (riesgos), el titular de registro deberá actualizar el PGR y enviarlo a la ANM (Centro Nacional de Farmacovigilancia y Tecnovigilancia).
Tecnovigilancia
Actualizado al 25/02/2025
La acción de seguridad en campo (ASC) es una acción emprendida por un fabricante para reducir el riesgo de muerte o deterioro grave del estado de salud del paciente asociado al uso del dispositivo médico. Tales acciones se notifican mediante una Nota de Seguridad en Campo. La ASC puede incluir:
- La devolución del dispositivo médico al TRS o TCRS
- La modificación del DM
- El cambio del DM por otro
- La destrucción del DM
- La adaptación del DM por el TRS y/o TCRS según la modificación o cambio de diseño efectuado por el fabricante.
- Las recomendaciones del fabricante en cuanto al uso del DM o al seguimiento de los pacientes (por ejemplo, cuando el DM se ha dejado de comercializar o retirado del mercado, pero este todavía en uso como el caso de los implantes o en los cambios de la sensibilidad analítica de los DM para diagnóstico)
- Otros que el fabricante considere necesario.
Formatos:
Acciones de Campo:
Son resúmenes de los comunicados de seguridad de DM que cuentan con registro sanitario autorizado en el país, provenientes de las autoridades reguladoras de países de alta vigilancia sanitaria, y que DIGEMID publica con el fin de minimizar los riesgos asociados a su uso y realizar el monitoreo de las acciones de seguridad en campo, las cuales son realizadas por el fabricante en coordinación con el titular de registro sanitario en el Perú.
- Generalidades de Tecnovigilancia
- Reporte de SIADM por Profesionales de la salud
- Reporte de SIADM por TRS/TCRS
- Evaluación de la Causalidad de SIADM
- AMFE Documentario
- AMFE Teórico
- AMFE Practico
- Informe Periódico de Seguridad
- Acción Correctiva de seguridad en campo
